NTM Elite agar
Wybiórcza izolacja prątków niegruźliczych
Agar NTM Elite to innowacyjne, selektywne podłoże do izolacji prątków niegruźliczych (Non-Tuberculous Mycobacterium, NTM) z próbek pobranych z dróg oddechowych, w tym próbek pobranych od pacjentów z mukowiscydozą
- Wysoka żyzność i selektywność
- Brak konieczności wykonania etapu kontaminacji
- Podłoże można stosować w rutynowym laboratorium mikrobiologicznym
Potrzebujesz więcej informacji
Powszechnie występujące w środowisku prątki niegruźlicze (NTM) są patogenami oportunistycznymi, które mogą powodować przewlekłe choroby płuc. Gatunkami najczęściej obserwowanymi w przypadku infekcji płuc są M. abscessus i M.avium complex. W związku z postępującym uszkodzeniem płuc M. abscessus jest również najbardziej lekoopornym prątkiem niezwykle trudnym w leczeniu.(1)
U pacjentów cierpiących na mukowiscydozę, przewlekłą obturacyjną chorobę płuc lub rozstrzenie oskrzeli wiarygodne rozpoznanie zakażenia NTM pozwala lekarzom w doborze właściwego leczenia i wdrożeniu odpowiednich leków. Obecnie zalecane jest coroczne badanie przesiewowe w kierunku NTM, a w przypadku uzyskania wyniku dodatniego, niezbędna jest dalsza regularna kontrola.(2)
Podłoże NTM Elite przeznaczone jest do selektywnej hodowli NTM i jest wersją podłoża RGM. Umożliwia łatwiejszą i bardziej wiarygodną diagnostykę w porównaniu z powszechnie stosowanymi podłożami używanymi do hodowli prątków kwasoopornych (Acid-Fast Bacilli, AFB).
Uproszczona procedura pracy i wyższa dokładność
- Nie jest konieczny wcześniejszy etap dekontaminacji
- Wysoka selektywność: 85.6% w porównaniu do metody referencyjnej 18.6%*
- Dużo wyższa żyzność: 95% w porównaniu do metody referencyjnej 40%*
- Inkubacja w temperaturze 30°C poprawia wzrost NTM i blokuje wzrost prątków BSL3**
- Do użytku w rutynowych procedurach BSL2** stosowanych w laboratoriach mikrobiologicznych
* w porównaniu z metodą referencyjną AFB: pożywka Lowensteina Jensena połączona z pożywką MGIT
** BSL: BioSafety Level (Poziom Bezpieczeństwa Biologicznego)
Łatwiejszy odczyt

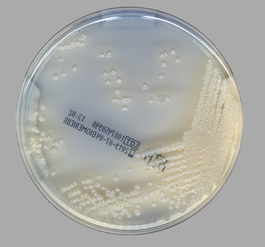
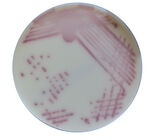
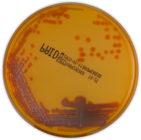
Jałowa płytka
Kolonie M. abscessus po 5 dniach
Prątki szybko rosnące (Rapid Growing Mycobacteria, RGM) < 7 dni
Kolonie M. chelonae po 5 dniach
Kolonie M. girdinae po 17 dniach
Prątki wolno rosnące (Slow Growing Mycobacteria) > 7 dni
Kolonie M.avium complex po 17 dniach
(1)Pulmonary disease by non-tuberculous mycobacteria - clinical management, unmet needs and future perspectives.
Larsson, L. O., E. Polverino, W. Hoefsloot, L. R. Codecasa, R. Diel, S. G. Jenkins and M. R. Loebinger
Expert Rev Respir Med 2017 11(12): 977-989.
Link do portalu PubMed: https://www.ncbi.nlm.nih.gov/pubmed/28967797
Link do strony publikacji: https://www.tandfonline.com/doi/abstract/10.1080/17476348.2017.1386563
(2)US Cystic Fibrosis Foundation and European Cystic Fibrosis Society consensus recommendations for the management of non-tuberculous mycobacteria in individuals with cystic fibrosis.
Floto, R. A., K. N. Olivier, L. Saiman, C. L. Daley, J. L. Herrmann, J. A. Nick, P. G. Noone, D. Bilton, P. Corris, R. L. Gibson, S. E. Hempstead, K. Koetz, K. A. Sabadosa, I. Sermet-Gaudelus, A. R. Smyth, J. van Ingen, R. J. Wallace, K. L. Winthrop, B. C. Marshall and C. S. Haworth
Thorax 2016 71 Suppl 1: i1-22.
Link do portalu PubMed: https://www.ncbi.nlm.nih.gov/pubmed/26666259
Link do strony publikacji: https://thorax.bmj.com/content/71/Suppl_1/i1.long
| Podłoże agarowe NTM Elite agar | ||
|---|---|---|
 |
Nr kat. 423144 | 20 płytek x 90 mm |
ARTYKUŁY
- Stephenson D, et al. (Freeman Hospital). An evaluation of methods for the isolation of nontuberculous mycobacteria from patients with cystic fibrosis, bronchiectasis and patients assessed for lung transplantation. BMC Pulmonary Medicine (2019).
https://www.ncbi.nlm.nih.gov/pubmed/30665395 - Brown-Elliott BA, et al. Evaluation of a novel rapidly-growing mycobacteria medium for isolation of Mycobacterium abscessus complex from respiratory specimens from patients with bronchiectasis. Heliyon, 2019.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6820269/ - Rotcheewaphan S, et al (NIH). Performance of RGM Medium for Isolation of Non Tuberculous Mycobacteria from Respiratory Specimens from Non-Cystic Fibrosis Patients. Journal of Clinical Microbiology. February 2019 Volume 57 Issue 2.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6355514/ - Scohy A, et al. Comparison of the RGM medium and the mycobacterial growth indicator tube automated system for isolation of non-tuberculous mycobacteria from sputum samples of cystic fibrosis in Belgium. J Clin Tuberc Other Mycobact Dis. 2018.
https://www.ncbi.nlm.nih.gov/pubmed/31720403 - Plongla R, et al. (Chapel Hill NC). Evaluation of RGM Medium for Isolation of Non Tuberculous Mycobacteria from Respiratory Samples from Patients with Cystic Fibrosis in the United States. Journal of Clinical Microbiology. May 2017 Volume 55 Issue 5. 1469-1477.
https://www.ncbi.nlm.nih.gov/pubmed/28228494 - Eltringham I, et al. Comparison of mycobacterial growth indicator tube with culture on RGM selective agar for detection of mycobacteria in sputum samples from patients with cystic fibrosis. Journal of Clinical Microbiology, 2016 August.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4963527/ - Preece CL, et al. (Freeman Hospital). Evaluation of Various Culture Media for Detection of Rapidly Growing Mycobacteria from Patients with Cystic Fibrosis. Journal of Clinical Microbiology. July 2016 Volume 54 Number 7. 1797-1803.
https://www.ncbi.nlm.nih.gov/pubmed/27098962 - Preece CL, et al. (Freeman Hospital). A novel culture medium for isolation of rapidly-growing mycobacteria from the sputum of patients with cystic fibrosis. Journal of Cystic Fibrosis 15 (2016) 186-191.
https://www.ncbi.nlm.nih.gov/pubmed/26002312
PLAKATY
ECCMID 2020
- Perry J, et al. Decontamination strategies used for AFB culture significantly reduce the viability of Mycobacterium abscessus in sputum samples from patients with cystic fibrosis.
Abstract # 2188. Session: Increasing knowledge on NTMs - PS022. Poster # P0517. - Vrignaud M, et al. Compatibility of the new NTM Elite agar with MALDI-TOF for direct isolation and identification of non-tuberculous mycobacteria.
Abstract # 2646. Session: Increasing knowledge on NTMs - PS022. Poster # P0511. - Vrignaud M, et al. Performances comparison between rapidly growing mycobacteria medium for direct-isolation of non-tuberculous mycobacteria, and its industrial version.
Abstract # 2047. Session: Increasing knowledge on NTMs - PS022- Poster # P0512. - Gafsi J et al. Performance of the NTM Elite agar for the detection of non-tuberculous mycobacteria in sputum samples of patients with cystic fibrosis.
Abstract # 5277. Session: Clinical challenges and culture-based diagnostics – PS104. Poster # P2407.
Publikacja ECCMID Abstract Book 2020 jest dostępna w formacie PDF za darmo na stronie ESCMID.
Plakat można odnaleźć pod wskazanym numerem.
ASM 2020
- Vrignaud M, et al. Appropriateness of Utilization of NTM Elite agar for the Diagnosis of Nontuberculous Mycobacteria Outside Biosafety Level 3 Laboratories.
Abstract # 4705.